
Rev. Fac. Agron. (LUZ). 1998, 15: 115-122
Efecto de los métodos de transporte y aclimatación sobre las
características y rendimiento de las plantas de plátano Hartón (Musa AAB)
originadas por cultivos de tejidos1
Effect of transportation and acclimatation methods on the characteristic and yield of plantain Horn (Musa AAB) plants propagated through tissue culture
Recibido el 31-05-1996l Aceptado el
07-11-1997
1. Proyecto financiado por el Consejo de Desarrollo Científico y Humanístico (CONDES) de
La Universidad del Zulia.
2. Departamento de Agronomía, Facultad de Agronomía, La Universidad del Zulia. Apartado
15205, Maracaibo ZU 4005, Venezuela.
C. Nava2 y E. Villarreal2
Resumen
Palabras claves: Plátano Harton (Musa AAB), cultivo de tejido, transporte,
aclimatación.
Abstract
Key words: Horn Plantain (Musa AAB); tissue culture; transportation;
acclimatization.
Introducción
Las plantaciones de plátano en Venezuela son del clon Harton (Musa AAB); todas las plantaciones, 60.000 ha aproximadamente, son originadas de cormos o hijos de diferentes tamaños y condiciones, lo cual ha originado plantaciones desuniformes con diferentes problemas.
La primera información sobre la propagación in vitro en cultivares de Musa fue realizada por Ma y Shii, 1972; citados por Hwang et al (1) luego el uso de este tipo de material de propagación es una práctica común en algunos cultivos. En la industria platanera de este país no tiene aún amplia aplica-ción, se ofrece material de algunos clones y se inicia su uso en pequeña escala.
A pesar del número de informes publicados no se mencionan problemas de transporte, ni método de siembra en el rubro plátano.
Hwang et al (1) informan sobre una sobrevivencia en campo de 90 por ciento y un similar comportamiento con los materiales originados de hijos en el clon Grand Nain (Musa AAA).
En la naturaleza, en plantaciones originadas de hijos, se presentan normalmente mutaciones somaclonales como cambios de color en el follaje y seudotallo y en el tipo de racimo, entre otros. Experimentalmente, en plantas micropropagadas, Robinson et al (2) con los clones William, Dwarf Cavendish y Grand Nain (Musa AAA) informan de variaciones somaclonales. Así mismo Ventura et al (5), Vuylsteke et al (6). Sandoval et al (4) y Robinson et al (2) trabajando con el clon Falso Harton informan sobre la reversión del racimo a Domínico hasta niveles mayores al 10 %. También con el mismo clon Rodriguez et al (3) consiguieron ciclo más largo en plantas micropropagadas pero rendimientos semejantes.
El objetivo de este trabajo es el de estudiar el comportamiento de las plantas micropropagadas en su traslado, aclimatación y campo.
Materiales y Métodos
Materiales de propagación. Todo el material de propagación se obtuvo en la Finca de los hermanos Nicolieri, km. 35, carretera Santa Barbara-El Vigia, Municipio Colón, Estado Zulia.
a) El material de propagación in vitro se originó 8 meses antes, cuando el laboratorio Agricar (Turgua-Miranda) seleccionó hijos chupones de 40 a 50 cm de altura procesándolos por métodos convencionales, hasta la obtención de plántulas, manteniéndolas en bandejas en sus viveros de Turgua-Edo. Miranda, en bandejas hasta 20 cm de altura.
b) Semillas o cormos, provenientes de hijos de 1,00 a 1,20 m de altura.
Transporte y aclimatación. El material micropropagado se dividió en dos lotes, un lote se mantuvo en el vivero de la empresa, el otro lote se trasladó al área de siembra en el Sur del Lago de Maracaibo; la mitad de este segundo lote iba en bandeja con su substrato, la otra mitad a raíz desnuda envuelto en papel húmedo. Una vez en el área todo el material se colocó en bolsa de polietileno, con un substrato tierra-arena 1:1 v/v, y se mantuvo en el Vivero Corpozulia por 15 días a temperatura ambiental bajo techo de zaran, media sombra y riego diario; al término de este periodo las plantulas dejadas en el Vivero Agricar fueron trasladadas al área de siembra, bajo las mismas condiciones del primer lote, llevándose directamente al campo, junto con el material colocado en bolsas plásticas (figura 1). De modo que se tenían 4 tratamientos y un testigo:
Aclimatados en la zona:
1. Transportadas en Bandejas
2. Transportadas a Raíz desnuda Aclimatados en el laboratorio:
3. Transportadas en Bandejas
4. Transportadas a Raíz desnuda
Como material de comparación (testigo) se sembraron los hijos chupones descritos en b.
Cada parcela/tratamiento tenía 9 plantas dispuestas en tres plantas de tres hileras en un diseño experimental de 4 bloques al azar.
Todos los materiales se sembraron en julio 1994 a 3 x 3 m en la plantación comercial de los Hermanos Nicolieri ubicada en el Municipio Colón, carretera Santa Bárbara, El Vigia, km 35.
Mantenimiento de la plantación. En la primera fase de creci-miento de las plantas el control de malezas se efectuó a machete, luego con herbicidas, cuando se consideró necesario, para evitar la competencia de las malezas con el cultivo. Los productos utilizados fueron Gramozone (Paraquat) 1% v/v del p.c. 400 L/ha. y Roundup (Glifosato) 1,5% v/v del p.c. a 300 L/ha.
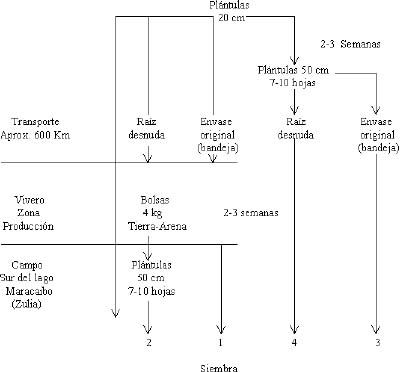
Figura 1. Manejo de las plántulas en el vivero del laboratorio, su transporte y en el vivero de la zona productora.
La fertilización se efectuó a los 3 meses después de la siembra con nitrógeno en forma de úrea (350 g por cepa) y luego a los 6 meses y al año y cada 6 meses con fórmula completa 15-15-15 450 g por unidad mínima de producción colocado a 30 cm y frente al hijo de crecimiento. El deshoje, eliminación de hojas secas y dañadas por sigatoka amarilla y negra se efectuaba cada 15 días a partir del quinto mes del crecimiento de las plantas. El control químico, con fungicidas contra la Sigatoka Negra se hizo con equipo aéreo en conjunto con la plantación comercial después de los cinco meses de la siembra distanciándose de tres semanas a un mes dependiendo de la intensidad de ataque en las hojas del hongo de la Sigatoka Negra.
Las observaciones sobre la floración se realizaron cada semana, a partir de la aparición de la primera flor, anotando la emergencia de la flor, la altura de la planta y el número de hojas al mismo tiempo; la cosecha se efectuaba cada 15 días cortando el racimo con machete, cuando se consideró en condiciones para el mercado, entendiéndose como tal cuando los frutos están llenos y las aristas redondeados y poco prominentes.
Una vez cosechado el racimo este se pesó, y anotó el número de manos y dedos En total se realizaron las siguientes observaciones de campo:
·Germinación de los cormos y sobrevivencia de las plantulas.
·Características de la planta: Altura de la planta desde el nivel del suelo a la cruz de separación de los hijos, cm.
Número de hojas, al inicio de la floración.
·Ciclo:días desde la siembra a floración, días desde la siembra a la cosecha, días colgando o de llenado.
·Producción:Peso del racimo (kg), número de dedos y manos.
Resultados y discusión
Germinación y sobrevivencia. Las "semillas" o cormos germinaron en un 97,2%, mientras los tratamientos de plantas micropropagadas transportadas en bandejas sobrevivieron en 93,0% y las trasladadas a raíz desnudas lo hicieron en 68,0%. Los hijos presentaron un porcentaje superior en germinación y dentro de las plantas micropropagadas las transportadas en bandejas fueron superiores a las transportadas a raíz desnuda. (cuadro 1).
Variación en el tipo de plantas. Es normal observar en las plantaciones de plátano Harton algunos racimos de plátano Dominico, siempre en muy bajo porcentaje. En este caso no se vio variación en el racimo en las plantas originadas de cormos, pero si se observó en el racimo de las plantas originadas de meristemas, en un 2,8% que aunque luce alto para la variación natural, es bajo para el proceso in vitro, ya que estascifras son menores que las obtenidas por Ventura et al (5) con Falso Harton y similares a las obtenidas por Vuylsteke et al (6) con el clon Agbagba, Falso Harton, en Nigeria.
Características de la planta. En la altura de plantas y número de hojas a floración no se observaron diferencias entre los tratamientos con medias de 3,57 m y 13,2 hojas, respectivamente.
Ciclo. Se encontraron diferencias en el ciclo de las plantas en los diversos tratamientos para días desde la siembra a floración, días desde el llenado y días desde la siembra a cosecha (cuadro 2).
El ciclo de las plantas trasladadas con su substrato en bandejas (295 días) fue más corto que el de las plantas trasladadas a raíz desnuda (322 días). El ciclo de las plantas provenientes de hijos fue intermedio, 303 días. No se observaron diferencias al evaluar el tipo de aclimatación (cuadro 3).
Producción. El peso promedio del racimo fue de 15,9 kg, para todos los tratamientos, con un máximo numérico de 16,7 kg en plantas de meristemas transportadas con su substrato en bandejas y aclimatadas en la zona, sin embargo, la prueba de media de Tukey indica que no se tiene diferencia entre ellas.
Cuadro 1. Sobrevivencia y germinación en plantas del clon Hartón originadas de meristemas in vitro e hijos, a 10 semanas después de la siembra.
| Tratamientos | Sobrevivencia, % | Germinación, % |
| Bandejas | 93,0 | |
| Raíz desnuda | 68,0 | |
| Hijos (cormos) | 97,2 |
Cuadro 2. Ciclo de las plantas del clon Harton originadas de meristemas e hijos.
| Tratamientos Nº Descripción | Observación Nº | Floración días | Cosecha días |
| 1 Bandeja - Zona | 34 | 212c | 295c |
| 2 Raíz desnuda - Zona | 26 | 253a | 327a |
| 3 Bandeja - Laboratorio | 31 | 213c | 295c |
| 4 Raíz desnuda-Laboratorio | 22 | 235b | 316ab |
| 5 Hijos | 35 | 218c | 303bc |
| Media | 224 | 306 | |
| M D S | 15,5 | 13,5 | |
| C V % | 8,8 | 6,0 |
Prueba de Tukey. Significancia al 5 %
Cuadro 3. Ciclo de las plantas del clon Harton originadas de meristemas e hijos, de acuerdo al Transporte.
| Tratamiento | Observación | Floración | Cosecha |
| Transporte | Nº | días | días |
| Bandejas | 65 | 213a | 295a |
| R. desnuda | 48 | 245b | 322b |
| Media | 226 | 306 | |
| M.D.S. | * 8,8 | 9,0 | |
| C V | 9,3 | 6,3 |
* Prueba de Tukey. Significancia al 5 %
Tampoco se observaron diferencias entre las medias de los diferentes tratamientos en el número de manos y dedos del racimo.
Conclusiones
El comportamiento de los materiales micropropagados bajo los diferentes tratamientos, comparado con los originados de cormos indica que aquellos tienen un comportamiento satisfactorio y similar al de los hijos en términos generales. Dentro del material micropropagado el material trasladado con su substrato en bandeja presentó menor ciclo que aquel trasladado a raíz desnuda, esto se debe a que sufrieron un menor "stress" y por ello reaccionaron con mayor vigor en el ambiente del sitio de siembra.
La metodología de transporte en bandejas y aclimatación en la zona de siembra puede ser aplicado por el productor platanero en el sur del Lago de Maracaibo, considerando que es fácil el traslado y la planta sufre menos; por estar aclimatadas cerca de la zona de siembra el material está a la disponibilidad del productor para cuando el terreno de siembra esté preparado, lo cual facilita la operabilidad de la práctica.
Agradecimiento
Al personal del laboratorio Agricar, por su colaboración en la obtención del material micropropagado.
Hermanos Nicolieri, por su apoyo al facilitar el terreno para la siembra y el personal obrero para el mantenimiento del experimento.
Ings. Agrónomos Ruddy Villalobos y Ciolys Colmenares, de la Facul-tad de Agronomía - LUZ, por su ayuda en el diseño y análisis de los datos.
Literatura citada
1.Hwang, S., C. Chen, J. Lin and H. Lin. 1984. Cultivation of banana using plantlets from meristem culture. Hortscience 19 (2): 231-233.
2. Robinson, J., C. Fraser and K. Eckstein. 1993. A field comparison of conventional suckers with tissue culture banana planting material over three crop cycles. In: INIBAT-ASPNET International Network for the Cultivation technology. Pingtung (TWN) 1992.
3. Rodriguez, W., J. Chavarria y J. Jiménez. 1985. Comparación de propágulos de Musa AAB. cv Saba cultivo de tejidos in vitro vs rizoma. Acorbat 7° Reunión. San José. Costa Rica. (Resumen).
4. Sandoval, F., A. Tapia, L. Muller y A. Villalobos. 1991. Observaciones sobre la variabilidad encontrada en plantas micropropagadas de Musa cv Falso Cuerno, AAB. Fruits 46(5): 533-539.
5. Ventura, J., M. Rojas y E. Yera, (Fra). 1988. Variación somaclonal en material de plátano (Musa spp) obtenido mediante micropropagación in vitro. Ciencia y Técnica en la Agricultura. Viandas Tropicales (Cuba) 11(1): 7-15.
6. Vuylsteke, D., R. Swennen and E. De Langhe, 1991. Somaclonal variation in plantains (Musa spp AAB group) derived from shoot-tip culture. Fruits (Fra) 46(4): 429-439.