
Rev. Fac. Agron. (LUZ). 1999, 16: 610-620
Anatomía foliar comparada de cinco genotipos de frijol mungo, Vigna
radiata (L.) Wilczek
Compared leaf anatomy in five genotypes of mungbean, Vigna radiata (L.) Wilczek
Recibido el 15-10-1999 l Aceptado
el 18-01-2000
Universidad Central de Venezuela, Facultad de Agronomía, Instituto de Botánica
Agrícola. Maracay - Edo. Aragua (2101). Apdo Postal 4579. e-mail: [email protected]
Resumen
Palabras clave: frijol mungo, anatomía foliar, genotipo, Vigna radiata.
Abstract
Key words: mungbean, leaf anatomy, genotype, Vigna radiata.
Introducción
El frijol mungo, Vigna radiata (L.) Wilezek, también conocido como `frijolito chino', es una leguminosa tropical comestible que pertenece a la familia Fabaceae, subfamilia Papilionoideae, señalándose su origen en India y Asia Central (11). Las semillas de este cultivo poseen buenos contenidos tanto de proteínas como de carbohidratos (24% y 58% respectivamente), razón por la cual tienen una amplia gama de usos en el consumo humano, bien como granos enteros, partidos o en forma de brotes tiernos (12).
En Venezuela, el frijol mungo es poco conocido debido a su reciente introducción, existiendo pequeñas siembras en el Occidente y Oriente del país. Este cultivo se caracteriza por soportar altas temperaturas superiores a los 25°C y por poseer un ciclo bastante corto (45-90 días), lo cual permite su siembra durante todo el año con riego complementario. Se considera que la expansión del cultivo podría aumentar considerablemente mediante el uso de genotipos promisorios y en tal sentido la Facultad de Agronomía de la Universidad Central de Venezuela, viene adelantando algunas investigaciones para evaluar el comportamiento de los genotipos introducidos y su manejo agronómico, a fin de seleccionar aquellos que resulten mejor adaptados a las condiciones agroecológicas del país (9, 13).
Desde el punto de vista anatómico, la información disponible en la literatura para el caso del frijol mungo es escasa o inexistente. Madriz (9) ha señalado que los diferentes genotipos de este cultivo, son bastante homogéneos en cuanto a su morfología externa, lo cual dificulta su identificación en condiciones de campo. Tomando en cuenta esos señalamientos, se consideró de interés el estudio de la histología de la lámina foliar en cinco genotipos de este cultivo previamente evaluados agronómicamente (9), con la finalidad de investigar la posible existencia de características de valor diagnóstico para la delimitación de éstos a nivel infraespecífico y adicionalmente relacionar algunos aspectos de la anatomía foliar con el comportamiento agronómico de los mismos.
Materiales y métodos
Se utilizó material correspondiente a la lámina foliar de plantas en fase de floración de los siguientes genotipos de frijol mungo: var. `Criolla', `VC1973', `VC2764B', `NM94' y `CHUN NAM 4'; la procedencia de cada uno de estos materiales ha sido descrita en un trabajo previo (9). El muestreo se realizó en una parcela experimental, ubicada en el Instituto de Agronomía de la Facultad de Agronomía Universidad Central de Venezuela, en Maracay, estado Aragua (455 msnm). En todos los genotipos, se seleccionaron al azar 3 plantas de las cuales se colectaron 6-8 hojas ubicadas en el estrato medio de las mismas, siendo posteriormente trasladadas al Laboratorio de Anatomía Vegetal de la misma Facultad, donde luego de ser lavadas con agua corriente, la porción correspondiente al tercio medio del folíolo central se fijó en FAA (formalina-ácido acético-etanol 70%) hasta su procesamiento.
Para el estudio al microscopio óptico se seleccionaron porciones de aproximadamente 1,5 cm2 (incluyendo el nervio medio), que fueron utilizadas para realizar secciones transversales a mano alzada; adicionalmente, se efectuaron macerados para el estudio de las epidermis en vista frontal, utilizando para ello una mezcla (V:V) de ácido nítrico y ácido crómico (ambos al 10%), en la cual se colocaron las muestras hasta la separación de las epidermis. Todas las preparaciones microscópicas se tiñeron con azul de toluidina acuosa al 1% y se montaron en agua:glicerina (V:V), para la obtención de láminas semipermanentes.
Las observaciones se hicieron en un microscopio marca Leitz, equipado con un ocular calibrado que fue usado para obtener las siguientes variables anatómicas cuantitativas: densidad de estomas y de tricomas en ambas epidermis, índice estomático de acuerdo a la fórmula de Salisbury citado por Wilkinson (15): IE= [(N°estomas/N° estomas + N° células epidérmicas) × 100] y grosor de la hoja; en cada caso se tomó un total de 40 medidas en diferentes preparaciones elegidas al azar, calculándose posteriormente los valores promedio, desviación estándar y coeficiente de variación. En algunas de las preparaciones se tomaron microfotografías, utilizando una cámara incorporada al microscopio.
Para el estudio de la morfología de la superficie foliar mediante Microscopía Electrónica de Barrido, del material previamente fijado se seleccionaron porciones de aprox. 1 cm2 que fueron deshidratadas en una bateria creciente de etanol y luego se trasladaron al Centro de Microscopía Electrónica de la Facultad de Agronomía de la Universidad Central de Venezuela, para realizarles un secado por punto crítico y se metalizaron con una capa fina de oro-paladio, efectuándose posteriormente las observaciones en un microscopio electrónico de barrido Phillips XL-20, tomándose microfotografías de los detalles que se consideraron relevantes.
Resultados y discusión
Los resultados obtenidos revelan una composición histológica bastante homogénea en los cinco genotipos investigados, entre los cuales sólo se observaron diferencias en lo que respecta a algunas de las variables cuantitativas determinadas.
En todos los casos, la epidermis adaxial y abaxial es unistrata, con células que en sección transversal se observan de forma tabular con paredes delgadas y cutícula poco evidente (figuras 2A, 2B); en vista frontal las células de la epidermis superior son de contorno recto a levemente ondulado (figuras 1A, 1D) en tanto que las de la epidermis inferior exhiben ondulaciones más o menos pronunciadas (figuras 1B, 1C, 1E). Los estomas se encuentran en ambas epidermis (hojas anfiestomáticas), lo cual parece ser común en integrantes de este género (5) y son en su mayoría paracíticos, pero también se observaron estomas paralelocíticos con células anexas de tamaño desigual (figuras 1D, 1E). Cabe señalar, que aún cuando el primer tipo de estoma es reportado como el más común en integrantes de la subfamilia Papilionoideae (2, 4, 5); la presencia de estomas paralelocíticos, también ha sido indicada en integrantes de la misma (10).
El tipo de tricoma, no resultó de valor diagnóstico ya que en todos los genotipos investigados se presentan dos (2) tipos de pelos en la epidermis: tricoma tector unicelular (figura 1B), en cuya base se observan varias células de contorno poligonal que se disponen a modo de roseta (figura 1A) y tricoma glandular de pedicelo corto formado por 3 células y cabeza globosa de contenido denso, constituida por 4 células (figuras 1E, 2B). Ambos tipos se observan indistintamente en las dos epidermis, pero el primero es más abundante en la cara adaxial, especialmente sobre las nervaduras, mientras que el segundo tipo predomina en la epidermis abaxial. Estos mismos tipos de tricomas, fueron descritos por Dahlin y col. (1), en tres cultivares de Phaseolus vulgaris L.
El estudio de la micromorfología de la superficie foliar, no reveló detalles anatómicos adicionales, a excepción de la presencia de estriaciones cuticulares en las células de ambas epidermis (figuras 2A, 2B), las cuales se observaron en forma común en todos los genotipos investigados. Cabe indicar, que esta característica ha sido reportada previamente por Flores y col. (2) en la epidermis foliar de Phaseolus vulgaris L.
La anatomía del mesófilo, también resultó similar en todos los genotipos investigados. Las hojas son bifaciales, con 2-3 estratos de células de parénquima clorofiliano en empalizada hacia la cara adaxial y 5-7 capas de parénquima esponjoso del lado abaxial (figuras 3A, 3B); en este último tejido, más o menos en posición media y en conexión con el floema de los haces vasculares, se observó un estrato de células de forma tabular, carentes de cloroplastos, con su eje mayor dispuesto paralelamente a la superficie de la lámina. Esta capa de células ha sido reportada en otros integrantes de la familia de las leguminosas (5, 6, 8), bajo la denominación de "mesófilo paravenal" y al parecer sus características estructurales, en combinación con su posición, sugieren que este tejido funciona como intermediario para hacer más eficiente el transporte de fotoasimilados y componentes nitrogenados, entre las células del mesófilo y el floema (8).
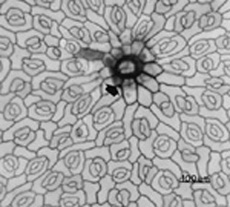 |
|
Figura 1. Detalles de la anatomía en vista frontal de la epidermis foliar en tres genotipos de frijol mungo, Vigna radiata (L) Wilczek. A. Epidermis adaxial var. CHUN NAM, indicando con flecha la base de un tricoma tector. 100X. B. Epidermis abaxial var. NM 94, mostrando un tricoma tector (tp). 100X. C. Epidermis abaxial var. Criolla mostrando con flechas varios tricomas glandulares. 100X. D. Epidermis adaxial var. Criolla. 400X. E. Epidermis abaxial var. Criolla. 400X.
Figura 2. Detalles de la micromorfología de la superficie foliar en frijol mungo, Vigna radiata (L) Wilczek var. Criolla. A. Epidermis adaxial; nótense estomas paracíticos y estriaciones cuticulares en las células pidérmicas. 1000X. B. Epidermis abaxial var. Criolla; obsérvense las estriaciones cuticulares, estomas y un tricoma glandular. 1000X.
Figura 3. Detalles de la anatomía de la lámina foliar en sección transversal en dos genotipos de frijol mungo Vigna radiata (L) Wilczek. A. Lámina foliar var. Criolla, mostrando epidermis adaxial (ead) y abaxial (eab), parénquima en empalizada (pem), parénquima esponjoso (pes) y mesófilo paravenal (mpv). 400X. B. Lámina var. NM94, resaltando con flecha un haz vascular transcurrente. 400X. C. Nervadura central var. Criolla. 40X. D. Detalle de la anterior, mostrando floema (f), xilema (x) y dos idioblastos de células secretoras (indicados con flechas). 400X.
El sistema vascular de la lámina está representado en todos los casos por haces colaterales cerrados, ubicados en el límite entre el parénquima en empalizada y el esponjoso o inmersos en este último tejido, posición esta considerada como común en hojas bifaciales (7). Con frecuencia, se observa una vaina parenquimática rodeando el haz vascular y en aquellos de mayor tamaño, ésta se prolonga hacia ambas epidermis, observándose haces transcurrentes (figura 3B).
En la figura 3C, se aprecia la conformación anatómica a nivel de la nervadura central, la cual tampoco difirió entre los genotipos estudiados; subepidérmicamente, se dispone un número variable de capas de colénquima angular (entre 2 y 5), seguidas por varios estratos de parénquima, que en la superficie adaxial se diferencian como parénquima clorofiliano. El tejido vascular se observa en la región central y está representado por haces colaterales abiertos, uno de mayor tamaño dispuesto hacia la superficie abaxial y 2-3 más pequeños, ubicados adaxialmente. Se notó además con frecuencia en esta región de la lámina, la presencia de células secretoras en forma de idioblastos (figura 3D).
En cuanto a las variables anatómicas cuantitativas determinadas en la lámina foliar de los 5 genotipos estudiados, en el cuadro 1 se presentan los resultados obtenidos. En lo que respecta a los estomas, se encontró que la densidad de éstos es siempre mayor en la superficie abaxial, lo cual es considerado como común en hojas anfiestomáticas (7); Los genotipos VC1973A y NM94, fueron los que exhibieron mayor densidad estomática en ambas epidermis, lo cual podría representar una característica favorable, ya que la presencia de una alta densidad de estomas por unidad de área de lámina, se ha correlacionado con una mejor capacidad fotosintética (14). Cabe señalar que de los genotipos investigados, el VC1973A ha sido reportado como uno de los de mejor comportamiento y rendimiento (1182,25 kg/ha) en condiciones de campo (9). A diferencia de la densidad de estomas, el índice estomático en ambas epidermis resultó bastante similar entre los genotipos estudiados, lo cual coincide con lo indicado por Wilkinson (15) quien señala que con frecuencia, este carácter suele variar poco entre genotipos de una misma especie.
En cuanto a la densidad de tricomas, las diferencias entre los genotipos investigados no resultaron muy pronunciadas; sin embargo, la variedad VC2764B resultó ser la más pubescente en ambas epidermis; en virtud de que el tejido epidérmico representa el punto inicial de contacto entre depredadores, parásitos y diversos agentes patógenos y la planta, la presencia de un mayor número de tricomas por unidad de área, podría representar una ventaja desde el punto de vista de defensa y adicionalmente se ha relacionado con una protección más efectiva contra el calentamiento de la superficie foliar, con la consecuente reducción de la pérdida de agua por transpiración (3). Cabe indicar que la variedad VC2764B, ha sido indicada por Madriz (9), como una de las de mejor rendimiento en época de secano (948 kg/ha).
Cuadro 1. Algunas variables anatómicas cuantitativas de la lámina foliar, en cinco genotipos de frijol mungo, Vigna radiata (L) Wilczek.
| Variedad | Densidad estomas (nº/mm2) | Indice estomático | Densidad tricomas (nº/mm2) | Grosor hoja (µm) | |||
| Adaxial | Abaxial | Adaxial | Abaxial | Adaxial | Abaxial | ||
| Criolla | 182,98 ± 10,42 | 347,92 ± 33,43 | 21,40 ± 0,20 | 27,08 ±0,46 | 4,85 ± 0,28 | 4,84 ± 0,22 | 345,23 ± 10,42 |
| VC1973A | 217,92 ± 15,42 | 425,84 ± 62,96 | 21,04 ± 0,59 | 26,89 ±0,73 | 3,65 ± 0,79 | 6,49 ± 0,58 | 298,67 ± 29,75 |
| VC2764B | 153,52 ± 18,81 | 363,72 ± 21,78 | 18,89 ± 0,55 | 25,97 ±0,28 | 6,30 ± 1,28 | 8,18 ± 1,26 | 317,13 ± 30,17 |
| NM94 | 219,15 ± 20,43 | 397,61 ± 19,26 | 18,24 ± 0,60 | 25,73 ±0,46 | 3,59 ± 0,38 | 6,49 ± 0,48 | 227,28 ± 21,88 |
| Chun Nam | 194,09 ± 6,81 | 351,29 ± 28,21 | 19,51 ± 0,77 | 25,11 ±0,27 | 2,96 ± 0,29 | 3,65 ± 1,63 | 317,85 ± 10,63 |
| CV | 14,90 | 11,62 | 25,94 | 4,34 | 32,00 | 30,51 | 15,21 |
CV: Coeficiente de Variación (%).
En cuanto al grosor de la hoja, también se observaron diferencias entre los genotipos estudiados, correspondiendo la lámina de mayor grosor a las variedades Criolla y Chun Nam (4), mientras que las hojas de menor espesor se observaron en la variedad NM94. No obstante, cabe señalar que este carácter es muy variable y puede diferir notablemente aún en hojas que ocupen diferentes posiciones en la misma planta (10).
Conclusiones
Los resultados descritos revelan una composición histológica bastante homogénea en los cinco genotipos investigados, aportando por lo tanto escasa información de utilidad para la delimitación de los mismos. Entre las características anatómicas más resaltantes de la lámina foliar pueden señalarse: hojas anfiestomáticas, con estomas en su mayoría parasíticos y dos tipos de tricomas (tectores unicelulares y glandulares multicelulares), mesófilo bifacial que incluye "mesófilo paravenal". Estas características son comúnes a otros miembros de la subfamilia Papilionoideae.
Las diferencias entre éstos en cuanto a ciertas variables anatómicas cuantitativas de la lámina foliar, tales como la densidad de estomas y de tricomas, resultan de utilidad como ayuda para una mejor interpretación del comportamiento agronómico de los genotipos estudiados.
Agradecimientos
Las autoras desean expresar su agradecimiento al Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela, por el financiamiento otorgado para la realización de la presente investigación mediante el Complemento a la Investigación N° 01.281.94.
Literatura citada
1. Dahlin, R., M. Brick y J. Oog. 1992. Characterization and density of trichomes on three common bean cultivars. Economic Botany 46: 299-304.
2. Flores, E., A. Espinoza y Y. Kosuka. 1977. Estudio ultraestructural de la epidermis foliar de Phaseolus vulgaris L. Turrialba 27: 117-124.
3. Johnson, H. 1975. Plant pubescense: and ecological perspective. Bot. Rev 41: 233-258.
4. Kothari, M y G. Shan. 1975. Epidermal ontogeny of stomata in the Papilionaceae (tribe Hedysareae). Bot. Gaz. 136: 372-379.
5. Lackey, J. 1978. Leaflet anatomy of Phaseoleae (Leguminosae: Papilionoideae) and its relation to taxonomy. Bot. Gaz. 139 (4): 436-446.
6. Lersten, N. y J. Curtis. 1993. Paraveinal mesophyll in Calliandra tweedii and C. emarginata (Leguminosae; mimosoideae). Am J. Bot. 80: 561-568.
7. Lindorf, H., L. Parisca y P. Rodríguez. 1991. Botánica. 2da. ed. Universidad Central de Venezuela, Ediciones de la Biblioteca. 584 p.
8. Liljebjelke, K. y V. Franceschi. 1991. Differentiation of mesophyll and paraveinal mesophyll in soybean leaf. Bot. Gaz. 152: 34-41.
9. Madriz, P. 1996. Caracterización y evaluación agronómica de genotipos de frijol mungo (Vigna radiata (L) Wilczek). Trabajo de Ascenso. Facultad de Agronomía, Universidad Central de Venezuela. Maracay. Mimeografiado. 125 p.
10. Metcalfe, C. y L. Chalk. 1983. Anatomy of the dicotyledons. Vol. II. 2nd ed. Clarendon Press, Oxford. 297 p.
11. Paroda, R. y T. Thomas. 1988. Genetic resources of mungbean, Vigna radiata (L) Wilczek in India. Mungbean: Proceedings of the 2nd International Symposium AVRDC, Shanhua, Taiwan. p: 19-28.
12. Prabhavat, S. 1988. Mungbean utilization in Thailand. Mungbean: Proceedings of the 2nd International Symposium AVRDC, Shanhua, Taiwan. p: 508-519.
13. Santaella, M. 1996. Evaluación de siete genotipos de frijol mungo, Vigna radiata (L) Wilczek. Trabajo de grado. Facultad de Agronomía, Universidad Central de Venezuela. Maracay. Mimeografiado. 126 p.
14. Tichá, I. 1982. Photosynthetic characteristics during ontogenesis of leaves. Photosynthetica 16: 375-471.
15. Wilkinson, H. 1979. The plant surface (mainly leaf). In: C. Metcalfe and L. Chalk (eds) Anatomy of the dicotyledons. Vol. I. 2nd ed. Clarendon Press, Oxford. p: 97-165.